Федеральное агентство по образованию
Волжский политехнический институт (филиал)
Волгоградского государственного технического университета
Кафедра: «Химия и общая химическая технология»
КУРСОВАЯ РАБОТА
по дисциплине: «Общая химическая технология»
Химико-технологические расчеты синтеза циклогексанона
производительностью 10 000 т/год и разработка
технологической схемы производства
Задание №15, вариант №5
Выполнил:
студент группы ВХТ-551
Проверил:
Волжский
Содержание
Введение………………………………………………………………………..3
- Расчет расходных коэффициентов синтеза циклогексанона ………….. 6
- Расчет теоретических расходных коэффициентов ………………… 6
- Расчет практических расходных коэффициентов ………………….. 7
- Расчет материального баланса …………………………………………… 7
- Расчет теоретического материального баланса …………………….. 8
- Расчет практического материального баланса ……………………... 10
- Тепловой баланс получения циклогексанона ……………………………12
- Термодинамический анализ основной реакции ………………………… 20
- Расчет константы равновесия и равновесного состава
реагирующих веществ ……………………………………………….. 27
- Эмпирические методы расчета тепловых эффектов ……………….. 29
- Кинетический расчёт……………………………………………………… 31
- Определение порядка реакции………………………………….……. 31
- Расчёт активационных параметров и установление
кинетической модели………………………………………………….. 37
- Сравнительный расчет изотермических реакторов
идеального смешения ………………………………………………… 39
- Расчёт реальных реакторов с учетом функции распределения ……….. 43
- Расчёт произвольной системы соединенных идеальных реакторов ….. 46
- Схема основного аппарата и его описание…………………………….... 50
- Технологическая и структурная схема и их описание ………………… 52
Выводы……………………………………………………………….…………55
Список литературы …………………………………………………….……. 56
ВВЕДЕНИЕ
В данной курсовой работе, была рассмотрена реакция синтеза циклогексанона. Для получения продукта реакции в качестве исходных веществ были взяты циклогексан и кислород.
Циклогексан – С6Н12 является существенной составной частью кавказской и американской нефти и может быть выделен из них [1]. В технике его получают каталитическим гидрированием бензола над никелевым или платиновым катализаторами при температуре около 200 °С:
Представляет собой бесцветную жидкость с приятным запахом. Широко используется как растворитель, однако прежде всего важен как исходное сырье для производства полиамидов, поскольку при его каталитическом окислении воздухом или кислородом в зависимости от условий реакции можно получить циклогексанол, циклогексанон или адипиновую кислоту:
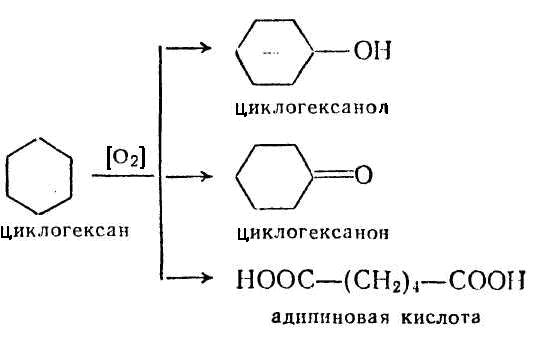
Циклогексанол – С6Н12О, маслянистая бесцветная жидкость или гигроскопичные кристаллы с запахом камфоры и сивушного масла [1].
![]()
Ограниченно растворим в воде, хорошо растворяется в большинстве органических растворителей; неограниченно смешивается с СО2 при 21-26 °С и 6,4 Мпа.
Промышленный синтез циклогексанола осуществляют:
- гидрированием фенола в паровой фазе при 130-150°C и давлении 1,5-2,5 МПа в присутствии Ni-Cr/Al2O3. Выход 98-99%:
- окислением циклогексана в жидкой фазе.
Применение: циклогексанол - промежуточный продукт в производстве адипиновой кислоты и циклогексанона; растворитель масел, восков, полимеров, красителей; стабилизатор эмульсий, смазочных масел, кремов; противовспениватель и гомогенизирующее средство, например, в дезинфицирующих препаратах; матирующее средство для химических волокон; интермедиат в производстве фармацевтических препаратов, пластификаторов, циклогексиламина, пестицидов.
Циклогексанон – С6Н10О – маслянистая бесцветная жидкость с запахом ацетона и мяты [1]. Растворимость циклогексанона в воде 9,9% (по объему), растворимость воды в циклогексаноне 5,8%.
По химическим свойствам циклогексанон – типичный представитель кетонов. Кислородом воздуха или HNO3 окисляется до адипиновой к-ты и низших моно- и дикарбоновых к-т, при окислении надуксусной к-той образуется капролактон; при кипячении с (СН3СО)2О - циклогексенилацетат, при действии CH2N2 -циклогептанон, в присутствии безводных минеральных к-т на холоду или щелочей при 100-150°С - 4-циклогексилиденциклогексанон.
В промышленности циклогексанон получают окислением циклогексана кислородом воздуха при 140-165 °С и давлении 0,9-1,6 МПа в присутствии нафтената или стеарата Со (0,25-2 г на 1 т циклогексана).
Другой промышленный способ получения циклогексанона - дегидрирование циклогексанола в паровой фазе при т-ре выше 220 °С и атм. давлении (в этих условиях равновесие реакции сдвинуто в сторону циклогексанона) в присутвии смешанных цинкхромовых (360-380 °С), медномагниевых (240-260 °С) или медноцинкхромалюминиевых (240 °С) катализаторов, степень превращения за один проход соотв. 60-65, 50 и 50%.
Циклогексанон применяют в производстве адипиновой к-ты, в качестве полупродукта в производстве e-капролактама, растворителя нитратов и ацетатов целлюлозы, жиров, восков, природных смол, поливинилхлорида, основных красителей; в качестве компонента средств для выведения пятен от краски [1].
Еще одним продуктом реакции является вода – наилучший растворитель в природе. Имеет температуру плавления равную 0 С и температуру кипения равную 100 С. Плотность воды равна 1 г/см3. Она обладает наибольшей среди всех других веществ теплоемкостью, равной 4,2 Дж/( г*град).
Основные свойства веществ участников реакции
Таблица 1.
Циклогексан |
О2 |
Циклогексанон |
Н2О |
Циклогексанол |
|
Молекулярная масса |
84,16 |
16 |
98,14 |
18 |
100,16 |
Температура плавления, °С |
6,6 |
- 218,4 |
-16,4 |
0 |
25,1 |
Температура кипения, °С |
80,8 |
- 183 |
155,7 |
100 |
161,1 |
Таким образом выше были рассмотрены физико-химические свойства веществ участников реакции [2].
Для получения циклогексанона в данной работе необходимо рассчитать предварительные затраты на исходное сырье, материальный баланс процесса, на основе материального баланса рассчитать тепловой баланс, выполнить термодинамический анализ данной реакции, а на основе кинетических расчетов составить кинетическую модель для данного процесса, а также с учетом всех технологических расчетов подобрать необходимый реактор для осуществления данного процесса и разработать технологическую схему производства циклогексанона.
1. Расчет расходных коэффициентов синтеза циклогексанона
Расходные коэффициенты – это величины характеризующие расход различных видов сырья, воды, топлива, электроэнергии, пара на единицу полученной продукции [3].
Особое значение имеют расходные коэффициенты по сырью, поскольку для большинства химических производств более 70% себестоимости составляет сырьё. Различают теоретические и практические расходные коэффициенты.
Основная реакция: С6Н12 + О2 → С6Н10О +Н2О
Побочная реакция: С6Н12 + 1/2О2 → С6Н11ОН
Производительность, т/год 10000
Число дней работы 309
Технологический выход, f, % 95
Молярное соотношение исходных А:В 1 : 1,8
Степень превращения, ХА, % 89
Селективность основной реакции, Ф, % 93
Состав исходных компонентов:
компонент А:
С6Н12, % 99,1
примесь С6Н6, % 0,9
компонент В:
О2, % 21
примесь N2, % 79
- Расчет теоретических расходных коэффициентов
Теоретические расходные коэффициенты учитывают расход исходного сырья с учетом стехиометрии реакции.
Основная реакция: С6Н12 + О2 → С6Н10О + Н2О
MА = 84,18 , MВ = 32 , MС= 98,16, MD = 18,02.
VА = 1, VВ = 1, VС = 1, VD = 1
Количество циклогексана, необходимое для получения 1 т циклогексанона
Количество кислорода, необходимое для получения 1 т циклогексанона
Количество полученной воды
- Расчет практических расходных коэффициентов
Практические расходные коэффициенты рассчитывают на основе теоретических с учетом основных технико-экономических показателей: степень превращения, селективность, выход продукта, а также состава исходного сырья, молярного соотношения исходных реагентов [3].
Количество циклогексана, необходимое для получения 1 т циклогексанона
Количество кислорода, необходимое для получения 1 т циклогексанона
- Расчет материального баланса
Расчет материального баланса осуществляют по заданной производительности целевого продукта с использованием основных технико-экономических показателей процесса: выход, селективность, степень превращения, молярного соотношения исходных реагентов, состава сырья.
Расчет удобнее проводить если заданную производительность выразить в единицах мольного потока (кмоль/мин, кмоль/ч, моль/с), а также по веществу, взятому в недостатке по отношению к стехиометрическому. Правильность составления материального баланса осуществляют по итоговым суммам прихода и расхода веществ, выраженных в единицах массового потока [3].
Составление теоретического и практического материальных балансов стадии синтеза целесообразно выполнить в следующей последовательности:
− перевести годовую производительность реактора (Gm т/год) в производительность, выраженную в единицы мольного потока по формуле
где Gm0 − массовая производительность; Gn0 − мольная производительность;
Mr −молекулярная масса целевого продукта; N −число дней работы реактора в году.
Исходя из условия задания и стехиометрии реакции, определить вещества, находящиеся в недостатке; рассчитать мольный поток целевого продукта с учетом технологического выхода (потерь на стадии выделения)
(кмоль/мин),
где f – технологический выход;
Записать уравнение материального баланса, напр.
GА + GВ + Gприм. = GД + GЕ + GА1 + GВ1 + Gприм.,
где Gприм. − примеси с исходными реагентами; GА1, GВ1 − количество непрореагировавшего сырья.
- Расчет теоретического материального баланса
Основная реакция: С6Н12 + О2 → С6Н10О +Н2О
Побочная реакция: С6Н12 + 1/2О2 → С6Н11ОН
Производительность, т/год 10000
Число дней работы 309
Технологический выход, f, % 95
Молярное соотношение исходных А:В 1 : 1,8
Степень превращения, ХА, % 89
Селективность основной реакции, Ф, % 93
Состав исходных компонентов:
компонент А:
С6Н12, % 99,1
примесь С6Н6, % 0,9
компонент В:
О2, % 21
примесь N2, % 79
Составляем теоретический материальный баланс синтеза циклогексанона.
Основная реакция: С6Н12 + О2 → С6Н10О + Н2О
MА = 84,18 , MВ = 32 , MС= 98,16, MD = 18,02.
VА = 1, VВ = 1, VС = 1, VD = 1
Выразим массовую производительность реактора в мольную производительность.
Количество циклогексана, необходимое для получения циклогексанона
Количество кислорода, необходимое для получения циклогексанона
Количество полученного циклогексанона
Количество полученной воды
Результаты расчета заносим в таблицу 3.
Теоретический материальный баланс
Таблица 3.
Сырье |
Приход |
|||
кмоль/мин |
% моль |
кг/мин |
% масс |
|
С6Н12 |
0,229 |
50 |
19,277 |
72,5 |
О2 |
0,229 |
50 |
7,328 |
27,5 |
Итого |
0,458 |
100 |
26,605 |
100 |
Расход |
||||
С6Н10О |
0,229 |
50 |
22,479 |
84,5 |
Н2О |
0,229 |
50 |
4,126 |
15,5 |
Итого |
0,458 |
100 |
26,605 |
100 |
Вывод: из расчета теоретического материального баланса в соответствии с законом сохранения массы вещества видно, что вещества вступают в реакцию в равных количествах, т. е для получения 0,229 кмоль циклогексанона надо взять эквивалентное количество циклогексана и столько же кислорода.
- Расчет практического материального баланса.
Основная реакция: С6Н12 + О2 → С6Н10О +Н2О
Побочная реакция: С6Н12 + 1/2О2 → С6Н11ОН
Переведем производительность реактора, выраженную в единицу массового потока в мольную производительность.
Приход:
1. Количество циклогексана, требуемого для получения циклогексанона.
Gn1 = G’n0*
2. Количество циклогексана, с учетом селективности
Gn2 =
3. Количество циклогексана, с учетом степени превращения.
Gn3 =
4. Количество циклогексана пошедшее на побочную реакцию.
Gn4 = Gn2 − Gn1 = 0,259 – 0,241=0,018 кмоль/мин
5. Количество не прореагировавшего циклогексана
Gn7 = Gn3 − Gn2 = 0,291 - 0,259=0,032 кмоль/мин
6. Количество циклогексана в пересчете на 100% (с учетом примесей).
Gn8=
Из них на примеси бензола
Gn9=Gn8*(1 - iA) = 0,2936*(1 – 0,991)=0,0026 кмоль/мин
7 Количество кислорода, необходимого для получения циклогексанона
Из заданного соотношения исходных веществ 1 : 1,8:
Gn10=1,8*0,291=0,524 кмоль/мин
9 Количество кислорода в пересчете на 100%.
Gn11=
Из них на примеси азота
Gn12=Gn11*(1 - iВ) = 2,494*(1 – 0,21)=1,970 кмоль/мин
11. Количество кислорода, пошедшего на основную реакцию.
Gn13=Gn1*
12. Количество кислорода, пошедшего на побочную реакцию.
Gn14=Gn4*
13. Количество не прореагировавшего кислорода
Gn16 = Gn10 − Gn13 − Gn14 = 0,524 - 0,241 – 0,009 = 0,274 кмоль/мин
Расход:
1. Количество С6Н10О, образующееся после основной реакции.
Gn17 = G’n0=0,241 кмоль/мин
2. Количество образовавшегося С6Н12О в побочной реакции.
Gn18=Gn5*
6. Количество образовавшейся Н2О в основной реакции
Gn20=Gn0*
Полученные данные материального баланса заносим в таблицу 4.
Практический материальный баланс
Таблица 4
Вещество |
Приход |
Вещество |
Расход |
||||||
кг/мин |
%, |
кмоль/ мин |
%, |
кг/мин |
%, |
кмоль/ мин |
%, |
||
С6Н12 |
24,496 |
25,3 |
0,291 |
10,4 |
С6Н10О |
23,656 |
24,4 |
0,241 |
8,7 |
С6Н6 |
0,203 |
0,2 |
0,003 |
0,1 |
С6Н12О |
1,803 |
1,9 |
0,018 |
0,6 |
О2 |
16,768 |
17,4 |
0,524 |
18,8 |
Н2О |
4,343 |
4,5 |
0,241 |
8,7 |
N2 |
55,160 |
57,1 |
1,970 |
70,7 |
С6Н12 |
2,694 |
2,8 |
0,032 |
1,1 |
С6Н6 |
0,203 |
0,2 |
0,003 |
0,1 |
|||||
О2 |
8,768 |
9,1 |
0,274 |
9,8 |
|||||
N2 |
55,160 |
57,1 |
1,970 |
71 |
|||||
Итого |
96,627 |
100 |
100 |
Итого |
100 |
100 |
|||
Вывод: Таким образом из практического материального баланса видно, что материальный баланс, рассчитанный с учётом технологических критериев, соответствует закону действия масс() и для получения 23,656 кг С6Н10О, необходимо взять 24,496 кг С6Н12.
- Тепловой баланс получения циклогексанона
Цель теплового баланса заключается в определении количества тепла, которое необходимо подвести (или отвести) из зоны реакции для поддержания постоянной температуры, т.е. определить так называемую тепловую нагрузку на реактор. Тепловой баланс составляется для стадии синтеза при изотермическом режиме процесса. Тепловой баланс рассчитывается по данным материального баланса с учетом тепловых эффектов (экзотермический или эндотермический) химических реакций (испарение, конденсация, плавление, кристаллизация, возгонка), происходящих в реакторе, подвода тепла с исходным сырьем и отвода тепла с продуктами реакции, тепловых потерь [3].
Тепловой баланс составляется на основе закона сохранения энергии в соответствии с которым:
Qприм = Qрасх + Qпот.
Левая часть уравнения составляет тепло всех входящих потоков в реактора и энергетические потери.
Для стадии синтеза, в котором, наряду с процессами теплообмена, происходят химические превращения, сопровождающиеся выделением или поглощением тепла, уравнение теплового баланса принимает вид:
Qреаг = ±Qr ± QF = Qпрод + Qнагр + Qпот.
где Ореал − тепло, входящее в реактор с исходными реагентами;
Ореаг = Qi
Qi = Gi•Срi•Тi
где Gi − мольный поток i-реагента; Срi − теплоемкость i-реагента, дж/моль•К;
Тi − температура i-реагента, К;
Qr − тепло, выделяющиеся (или поглощается) в результате химических превращений:
Qr = − Hr,т•·Gi
где Hr,т − тепловой эффект химической реакции; Gi − мольный поток i-реагента, участвующего в реакции (или полученного продукта реакции).
При расчете следует обращать внимание на размерность и знак используемых величин. Если Qr>0, то значение Qr записывают в приход тепла, если Qr < 0, то в расход тепла с положительным знаком:
Qпрод − тепло, выходящее из реактора с продуктами реакции:
Qпрод. = Qj
Qj= Gj•Cpj•Tj
где Gj − мольный продукт j-продукта реакции; Tj − температура j-продукта реакции, К.
Qнагр. − количество тепла, расходуемого на нагревание исходных реагентов до температуры реакции:
Qнагр = [Gi•Cpi• (Ti,r − Ti)
где Gi − мольный поток i-реагента, подвергаемый нагреву; Cpi − теплоемкость i-реагента, дж/моль•К; Ti − температура i-реагента на входе в реактор; Ti,r − температура i-реагента на выходе из реактора.
Qпот − тепловые потери (1-5% от прихода тепла);
Qпот = (0,01 − 0,05)•Qприх
QF − количество тепла, отводимое (подводимое) от реактора при помощи теплоносителя:
QF = Qрасх − Qприх.
Если QF положительная величина, то её ставят в приход тепла, (тепло требуется дополнительно подводить) если QF < 0, то её ставят в расход тепла с положительным знаком, (тепло следует отводить).
Полученные результаты записывают в таблицу баланса стадии. Далее, исходя из тепловой нагрузки на реактор QF, следует рассчитать необходимую поверхность теплообмена:
где k − коэффициент теплопередачи; Т − движущая сила теплопередачи.
Данные для расчета теплового баланса:
Температура исходных реагентов, − 160 ˚С;
Температура продуктов реакции, − 380 ˚С;
Тепловые потери от прихода тепла − 6,6 %
В таблице 5 приведены термодинамические свойства веществ [2].
Термодинамические свойства веществ участников реакции
Таблица 5
Вещество |
∆H0298 кДж/моль |
S0298 Дж/моль*К |
Ср0298 Дж/моль*К |
Ср=f(Т) |
|||
а |
в*103 |
с*106 |
с΄*10-5 |
||||
С6Н12 |
-123,14 |
298,24 |
106,27 |
-51,71 |
598,77 |
-230,0 |
- |
С6Н6 |
82,93 |
269,3 |
81,67 |
-33,9 |
471,9 |
-298,3 |
- |
С6Н10О |
-268,36 |
330,5 |
27.32 |
227.86 |
-25.4 |
- |
|
Н2О |
-241,81 |
188,72 |
33,61 |
30,00 |
10,771 |
- |
0,33 |
С6Н12О |
-294,21 |
-13,26 |
721,9 |
-408,9 |
- |
||
О2 |
0 |
205,04 |
29,37 |
31,46 |
3,39 |
- |
-3,77 |
N2 |
0 |
191.50 |
29.12 |
27.88 |
4.27 |
- |
- |
- Рассчитаем количество тепла поступившего с исходными реагентами.
Qi=Gi*Cpi*Ti
Gi-количество веществ исходного выражения в [кмоль]
Ti=273+160=433K
Cpi=a+bT+c′/T2- для неорганических веществ
Cpi=a+bT+c*T2- для органических веществ
Cp(C6Н12)= -51,71+598,77*10-3*433К – 230*10-6*(433К)2 =164,43 Дж/моль*К
Qi(C6Н12 )=0,291*164,43*433К = 20718,673 кДж/мин
Cp(О2)=31,46+3,39*10-3*433К – 3,77*105/(433К)2 = 30,93 Дж/моль*К
Qi(О2)=0,524 * 30,93 * 433К = 7017,717 кДж/мин
Cp(N2)=27,88+4,27*10-3*433К = 29,729 Дж/моль*К
Qi(N2)=1,97 * 29,729 * 433К = 25359,057 кДж/мин
Сp(С6Н6)=-33,9+471,9*10-3*433К – 298,3*10-6*4332 = 114,505 Дж/моль*К Qi(С6Н6)=0,003 * 114,505 * 433К = 148,742 кДж/мин
∑Qi= 20718,673 + 7017,717 + 25359,057 + 148,742 = 53244,189 кДж/мин
- Рассчитаем количество тепла идущее на нагрев исходных веществ до температуры химической реакции.
Qiнагр=Gi*Cpi*(Tj-Ti)
Cpi- рассчитываем, исходя из средней температуры.
Cpi=a+bT+c′/T2- для неорганических веществ
Cpi=a+bT+c*T2- для органических веществ
Tj=3800C + 273 = 653 К
Tср=(Tj+Ti)/2=(433 + 653)/2=543 K
Тj-Ti=653К – 453К = 220 К
Cp(C6Н12)= -51,71 + 598,77*10-3*543К – 230*10-6*(543К)2 = 205,607 Дж/моль*К
Qнагр(C6Н12)=0,291 * 205,607 * 220К = 13126,949 кДж/мин
Сp(О2)=31,46 + 3,39*10-3*543К – 3,77*105 / (543К)2 = 32,057 Дж/моль*К
Qнагр(О2)=0,524 * 32,057 * 220К = 3695,493 кДж/мин
Cp(С6Н6)= - 33,9 + 471,9*10-3*543К – 298,3*10-6*5432 = 134,388 Дж/моль*К
Qнагр(С6Н6)=0,003 * 134,388 * 220К = 88,696 кДж/мин
Cp(N2)=27,88 + 4,27*10-3*543К = 30,199 Дж/моль*К
Qнагр(N2)=1,97 * 30,199 * 220К = 13088,077 кДж/мин
∑Qнагр= 13126,949 + 3695,493 + 88,696 + 13088,077 = 29999,215 кДж/мин
- Рассчитаем количество тепла, выделенное или поглощенное в ходе химической реакции.
Qr= - ΔHr,t*G
G=∑Gi= 0,291 +0,524 + 0,003 + 1,97 = 2,788 кмоль/мин
Tj=273 + 3800С=653K
Основная реакция:
∆H298=∆H(Н2О) + ∆H(С6Н10О) – ∆H(С6Н12) – ∆H(О2)=
= – 241,81 – 268,36 + 123,14 – 0= - 387,03 кДж/моль
∆a=a(H2O) + a(С6Н10О) – a(О2) – a(С6Н12) = 30,00 + 27,32 + 51,71 - 31,46 = 77,57
∆b= b(H2O) + b(С6Н10О) – b(О2) – b(С6Н12) = (227,86 +10,771 –598,77 – 3,39)*10-3=
= - 363,529*10-3
∆c= с(С6Н10О) - c(С6Н12) = -25,4*10-6 + 230*10-6 = 204,6*10-6
∆c'= c'(H2O) - c'(O2)= 0,33*105 + 3,77*105 = 4,1*105
∆Hr,t=ΔH298+Δa(T-298)+Δb/2(T2-2982)+Δc/3(T3-2983)+Δd/4(T4-2984)+
+Δc'(1/298 – 1/T)
∆Hr,653= - 387030 + 77,57(653-298) - 363,529*10-3(6532 - 2982)/2 +
+204,6*10-6(6533 - 2983)/3 + 4.1*105(1/298 - 1/653) = - 402924,1 Дж/моль
Q’r= - (-402924,1 Дж/моль*2,788 кмоль/мин) = 1123352,4 кДж/мин
Побочная реакция:
∆H298= ∆H(С6Н12О) – ∆H(С6Н12) – 0,5*∆H(О2)=
= – 294,21 + 123,14 – 0= - 171,07 кДж/моль
∆a= a(С6Н12О) – 0,5*a(О2) – a(С6Н12) = - 13,26 – 0,5*31,46 + 51,71 = 22,72
∆b= b(С6Н12О) – 0,5*b(О2) – b(С6Н12) = (721,9 – 0,5*3,39 – 598,77)*10-3=
= - 121,435*10-3
∆c= с(С6Н12О) - c(С6Н12) = - 408,9*10-6 + 230*10-6= - 178,9*10-6
∆c'= c'(H2O) - c'(O2)= 0,33*105 + 0,5*3,77*105 = 2,215*105
∆Hr,t=ΔH298+Δa(T-298)+Δb/2(T2-2982)+Δc/3(T3-2983)+Δd/4(T4-2984)+
+Δc'(1/298 – 1/T)
∆Hr,653= - 171070 + 22,72*(653-298) - 121,435*10-3(6532 - 2982)/2 –
- 178,9*10-6(6533 - 2983)/3 + 2.215*105(1/298 - 1/653) = - 198125,3 Дж/моль
Q”r= - (- 198125,3 * 2,788) = 552373,45 кДж/мин
Qr= 1123352,4 + 552373,45 = 1675725,85 кДж/мин
- Рассчитаем количество тепла уходящее с продуктами реакции.
Qj=Gj*Cpj*Tj
Cpj=a+bT+c′/T2- для неорганических веществ
Cpj=a+bT+c*T2- для органических веществ
Cp(С6Н12непр)= -51,71+598,77*10-3*653 - 230*10-6*6532 = 241,213 Дж/моль*К
Qпрод(С6Н12непр)= 0,032 *241,213*653 = 5040,381 кДж/мин
Cp(О2непр)= 31,46+3,39*10-3*653 - 3,77*105/(653)2 = 32,789 Дж/моль*К
Qпрод(О2непр)= 0,274 * 32,789 * 653 = 5866,673 кДж/мин
Cp(C6Н6)= - 33,9 + 471,9*10-3*653 – 298,3*10-6*6532 = 147,053 Дж/моль*К
Qпрод (C6Н6)= 0,003 * 147,053 * 653 = 288,077 кДж/мин
Cp(N2)=27.88+4.27*10-3*653 = 30,668Дж/моль*К
Qпрод (N2)= 1,97 * 30,668 * 653 = 39451,622 кДж/мин
Cp(H2O)=30,00 + 10,771*10-3*653 + 0,33*105/(653)2 = 37,111 Дж/моль*К
Qпрод (H2O)=0,241 * 37,111 * 653 = 5840,246 кДж/мин
Cp(С6Н10О)=27,32 + 227,86*10-3*653 + (-25,4*10-6)*6532 =165,282 Дж/моль*К
Qпрод (С6Н10О)= 0,241 * 165,282 * 653 = 26010,891 кДж/мин
Cp(С6Н12О)= -13,26 + 721,9*10-3*653 - 408,9*10-6*6532 = 283,782 Дж/моль*К
Qпрод (С6Н12О)=0,018 * 283,782 * 653 = 3335,574 кДж/мин
∑Qjпрод= 5040,381 + 5866,673 + 288,077 + 39451,622 + 5840,246 + 26010,891 +
+ 3335,574 = 85833,464 кДж/мин
- Рассчитаем количество тепла составляющие потери от прихода.
Qпотери=%потерь*Qприх
Qприх= Qi + Qr = 53244,189 + 1675725,85 = 1728970,039 кДж/мин
Qпотери= 1728970,039 * 0,066 = 114112,02 кДж/мин
- Рассчитаем количество тепла отводимого или подводимого химической реакции.
Qf=Qрасх-Qприх
Qрасх=∑Qjпрод+∑Qiнагр+∑Qпотер=85833,4+29999,2+114112,02=229944,62 кДж/мин
Qf = 229944,62 - 1728970,039 = - 1499025,42 кДж/мин
Т.к. Qf<0 , то тепло надо отводить в этом количестве.
- Рассчитаем поверхность теплообмена.
F=Qf / Kt*Δt
Kt- коэффициент теплопередачи.
Δt-разность температур.
F = 1499025,42 *103 / (200*220*60) = 567,8 м2
Результаты расчёта теплового баланса
Таблица 6
Приход |
Расход |
||||
Тепловые потери |
кДж/мин |
% |
Тепловые потери |
кДж/мин |
% |
∑Qi |
53244,19 |
3,08 |
∑Qiнагр |
85833,40 |
4,96 |
Qr |
1675725,85 |
96,92 |
∑Qj |
29999,20 |
1,74 |
Qпотер |
114112,02 |
6,60 |
|||
Qf |
1499025,42 |
86,70 |
|||
Итого |
1728970,04 |
100,00 |
Итого |
100,00 |
|
Вывод: Расчёт теплового баланса показал, что реакция является экзотермической и для её протекания необходимо отводить тепло в количестве 1499025,42 кДж/мин в реакторе, обладающем площадью теплообменной поверхности 567,8 м2.
4. Термодинамический анализ основной реакции.
При проектировании технологических процессов важное место занимают термодинамические химические реакции. Цель термодинамического анализа заключается в определении принципиальной возможности проведения химической реакции в данных условиях, в выборе условий проведения процесса, в расчете теплового эффекта реакции, что необходимо для составления теплового баланса.
Термодинамический анализ основывается на рассмотрении сравнительно ограниченного числа термодинамических функций, влияющих на энергетическую эффективность стадии синтеза. Для основной реакции необходимо рассчитать термодинамические функции: тепловой эффект реакции Hr,т, изменение энтропииSr,т, свободную энергию Гиббса Gr,т, константу равновесия Кр в заданном интервале температур. При расчете необходимо учитывать зависимость Ср = f(Т).
Термодинамические величины веществ участников реакции [2].
Таблица 7.
Вещество |
∆H0298 кДж/моль |
S0298 Дж/моль*К |
Ср0298 Дж/моль*К |
Ср=f(Т) |
|||
а |
в*103 |
с*106 |
с΄*10-5 |
||||
С6Н12 |
-123,14 |
298,24 |
106,27 |
-51,71 |
598,77 |
-230,0 |
- |
С6Н10О |
-268,36 |
330,5 |
27.32 |
227.86 |
-25.4 |
- |
|
Н2О |
-241,81 |
188,72 |
33,61 |
30,00 |
10,771 |
- |
0,33 |
О2 |
0 |
205,04 |
29,37 |
31,46 |
3,39 |
- |
-3,77 |
При расчете используют следующие формулы:
тепловой эффект реакции при стандартных условиях равен
H298 =(νi•H˚j,298 ) − ∑(νi•∆H˚j,298)исх.
где Hj298 − стандартные теплота образования вещества, кДж/моль;
Тепловой эффект реакции при температуре Т
,
где а =(νi•ai)кон. − ∑(νi•ai)исх;
в =(νi•вi)кон − ∑(νi•вi); исх
с =(νi•сi) кон. −(νi•сi) исх;
с' =(νi•с'i) кон. −(νi•с'i) исх.
Изменение энтропии реакции при стандартных условиях:
S298 = (νi•S˚j,298)кон − (νi•S˚j,298)исх
Изменение энтропии реакции при температуре Т:
Изменение энергии Гиббса реакции рассчитывают с использованием стандартных таблиц по уравнению:
Gт = Hт −Т•Sт
или по уравнению Темкина-Шварцмана
Из изотермы Вант-Гоффа определяют константу равновесия реакции:
lnКр = −Gт/RТ или Кр = ехр(− ΔGт/RT)
1) Рассчитаем тепловой эффект реакции.
∆H298=∆H(Н2О) + ∆H(С6Н10О) – ∆H(С6Н12) – ∆H(О2)=
= – 241,81 – 268,36 + 123,14 – 0= - 387,03 кДж/моль
∆a=a(H2O) + a(С6Н10О) – a(О2) – a(С6Н12) = 30,00 + 27,32 + 51,71 - 31,46 = 77,57
∆b= b(H2O) + b(С6Н10О) – b(О2) – b(С6Н12) = (227,86 +10,771 –598,77 – 3,39)*10-3=
= - 363,529*10-3
∆c= с(С6Н10О) - c(С6Н12) = -25,4*10-6 + 230*10-6 = 204,6*10-6
∆c'= c'(H2O) - c'(O2)= 0,33*105 + 3,77*105 = 4,1*105
∆Hr,t=ΔH298+Δa(T-298)+Δb/2(T2-2982)+Δc/3(T3-2983)+Δd/4(T4-2984)+
+Δc'(1/298 – 1/T)
Дж/моль Дж/моль
Дж/моль Дж/моль
Дж/моль Дж/моль
Дж/моль Дж/моль
Дж/моль Дж/моль
2) Определим изменение энтропии.
∆S˚298 = ∑∆S˚под − ∑∆S˚реаг = 330,5 + 188,72 – 298,24 – 205,04= 15,94 Дж/моль*К
Дж/моль*К Дж/моль*К
Дж/моль*К Дж/моль*К
Дж/моль*К Дж/моль*К
Дж/моль*К Дж/моль*К
Дж/моль*К Дж/моль*К
3) Определим изменение энергии Гиббса.
∆GT = ∆HT − T∆ST
- 387312,7 – 15,376*323 = - 392279,187 Дж/моль
Дж/моль Дж/моль
Дж/моль Дж/моль
Дж/моль Дж/моль
Дж/моль Дж/моль
Дж/моль Дж/моль
4) Из уравнения изотермы Вант – Гоффа определим Кр
lnKp = − Kp = e
lnKp323 = Kp323 = 2,758*1063
lnKp358 =132,010 Kp358=2,144*1057
lnKp393 = 120,421 Kp393=1,987*1052
lnKp428 = 110,698 Kp428=1,189*1048
lnKp463 = 102,415 Kp463=3,007*1044
lnKp498 = 95,266 Kp498=2,363*1041
lnKp533 = 89,027 Kp533=4,611*1038
lnKp568 = 83,528 Kp568=1,887*1036
lnKp603 = 78,641 Kp603=1,423*1034
lnKp638 = 74,264 Kp638=1,789*1032
lnKp673 = 70,318 Kp673=3,458*1030
Графики зависимостей:Hт = f(Т), Sт = f(Т), Gт = f(Т), lnКр = f(1/Т), Кр = f(Т) представлены, соответственно на рисунках 1, 2, 3, 4, 5.
Результаты термодинамических расчетов приведены в таблице 8.
Зависимость термодинамических функций от температуры.
Таблица 8.
№ |
Т, К |
∆Н, Дж/моль |
∆S, Дж/моль*К |
∆G, Дж/моль |
lnKp |
Kp |
1 |
323 |
-387312,7 |
15,376 |
-392279,187 |
146,0773 |
2,758*1063 |
2 |
358 |
-387975,1 |
13,802 |
-392916,221 |
132,01 |
2,144*1057 |
3 |
393 |
-388925,4 |
11,547 |
-393463,513 |
120,4209 |
1,987*1052 |
4 |
428 |
-390140,7 |
8,798 |
-393906,091 |
110,6978 |
1,189*1048 |
5 |
463 |
-391599,7 |
5,687 |
-394232,883 |
102,4146 |
3,007*1044 |
6 |
498 |
-393282,1 |
2,317 |
-394435,826 |
95,26579 |
2,363*1041 |
7 |
533 |
-395168,3 |
-1,237 |
-394509,229 |
89,02663 |
4,611*1038 |
8 |
568 |
-397239,4 |
-4,912 |
-394449,305 |
83,52815 |
1,887*1036 |
9 |
603 |
-399476,6 |
-8,661 |
-394253,820 |
78,64092 |
1,423*1034 |
10 |
638 |
-401861,4 |
-12,445 |
-393921,818 |
74,26417 |
1,789*1032 |
11 |
673 |
-404375,6 |
-16,229 |
-393453,411 |
70,31828 |
3,458*1030 |
Рис 1. Зависимость энтальпии от температуры.
Из графика видно, что данная реакция в интервале температур 50 – 400 0С является экзотермической и её следует проводить при пониженной температуре.
Рис 2. Зависимость энтропии от температуры.
Из графика видно, что данная реакция в интервале температур 50-4000С обладает отрицательной энтропией и для её увеличения (т.е. повышения вероятности протекания реакции) необходимо понижать температуру системы.
Рис 3. Зависимость энергии Гиббса от температуры.
Из графика видно, что данная реакция в интервале температур 50-4000С обладает отрицательной энергией Гиббса, т.е. протекает самостоятельно в прямом направлении; для её ускорения необходимо понизить температуру.
Рис 4. Зависимость логарифма константы равновесия от обратной температуры.
,
Рис 5. Зависимость константы равновесия от температуры.
Из графика видно, что направление данной реакции в интервале температур 50-4000С смещено в сторону образования продуктов, т.к. константа равновесия много больше единицы.
Вывод: На основании полученных расчетов и построенных графиков можно сделать вывод, что в заданном температурном интервале реакция экзотермична (ΔН<<0), с увеличением температуры энтропия в системе уменьшается. Данная химическая реакция синтеза циклогексанона протекает самопроизвольно. Рассчитанное значение константы равновесия, показывает, что целесообразно принять за оптимальную температуру – 500С, т.к. при этой температуре константа равновесия значительно больше 1, что говорит о смещении равновесия в сторону продуктов реакции с большим выходом.
4.1. Расчет равновесного состава реагирующих веществ и химического равновесия.
По основной реакции и вычисленной константе равновесия, при температуре реакции (тепловой баланс), по константе равновесия рассчитать равновесный состав реакционной массы. При расчете использовать данные материального баланса.
A B C D
Дано: C6H12+O2 C6H10O+H2O
a b x x
a=0,291 кмоль/мин; b=0,524 кмоль/мин
Kp=P(H2O)*P(C6H10O ) / P(O2)*P(C6H12)
Kp=(N(H2O)*Pобщ)*(N(C6H10O)*Pобщ) / (N(C6H12)*Pобщ)*(N(О2)*Pобщ)=
= =KN
Расчёт производим в соответствии с законом действия масс и законом Дальтона [3]:
Пусть в начале химической реакции число молей веществ равно:
nA=a nB=b
Тогда в состоянии равновесия будет:
nA=a-x; nB=b-x; nC=x; nD=x;
Равновесные концентрации реагирующих веществ
Таблица 9.
N(C6H12), кмоль/мин |
N(O2), кмоль/мин |
n(C6H10O), кмоль/мин |
N(H2O), кмоль/мин |
|
Исходная смесь |
0,291 |
0,524 |
||
Образовалось |
x |
x |
||
Израсходовалось |
x |
x |
||
Осталось в сост-и равновесия |
0,291 - x |
0,524 - x |
x |
x |
=a-x+b-x+x+x=a+b=0,815 кмоль/мин
Мольные доли веществ в состоянии равновесия будут равны:
NA=, NB=, NC=, ND=
Рассчитаем Кр реакции для температуры 1700С:
∆Hr,443= - 387030 + 77,57(443 - 298) - 363,529*10-3(4432 - 2982)/2+
+ 204,6*10-6(4433 - 2983)/3 + 4.1*105(1/298 - 1/443)= - 390737,3 Дж/моль
∆S443= - 15,94 + 77,57ln(443/298) – 363,529*10-3(443 - 298) + 204,6*10-6*
*(4432 - 2982)/2 + 4,1*105(1/2982 - 1/4432)/2= 7,502 Дж/моль*К
ΔG443= - 390737,3 - 443*7,502 = - 394060,854 Дж/моль
Ln Kp443= - (- 394060,854/(8.314*443))= 106,9916
Kp= 2,92312*1046
Kp==2,92312*1046
x1=0,524 – не подходит, т.к. прореагировало больше, чем было до реакции.
x2=0,2909 кмоль/мин
Количество веществ А и В в состоянии равновесия:
= 0,291 - 0,2909 = 0,0001 кмоль/мин
= 0,524 - 0,2909 =0,2331 кмоль/мин
=0,2909 кмоль/мин; =0,2909 кмоль/мин
Мольные доли веществ в состоянии равновесия будут равны:
NA=0,0001/0,815=1,227*10-3
NB=0,2331/0,815=0,286
NC=ND=0.2909/0,815=0,3569
Вывод: Мольные доли веществ данной химической реакции в состоянии равновесия равны:
N(C6H 12)= 1,227*10-3
N(O2)= 0,286
N(C6H10O)=N(H2O)= 0,3569
т.е. циклогексан к моменту равновесия практически израсходовался.
4.2. Эмпирические методы расчета теплового эффекта.
Уравнение Коновалова. Используем для определения теплоты сгорания находящиеся в газообразном состоянии, принимая для соединения состоящее из атома, кислорода, углерода и азота:
∆Нºсгор298= − (48,8m + 10,6n + Δх), ккал/моль
где ∆Нºсгор298 − теплота сгорания органического соединения до СО2 и Н2О; m − число атомов кислорода, необходимое для полного сгорания вещества; n − число молей воды образующихся при сгорании; Δх − термическая характеристика
Уравнение Караша. Используем для расчета теплоты сгорания, вещества находящееся в жидком состоянии и принимаем для всех органических веществ:
∆Hºсгор298 = − 26,05(4С + Н − Р) + ∑νi•∆i; ккал/моль
где С − число атомов углерода в соединении; Н − число атомов водорода в соединении; Р − число частично смещенных электронов в соединении; νi − число одноименных заместителей; ∆i − соответствующая данному заместителю тепловая поправка.
Расчет ∆Hºобр298 органических соединений по энергиям связи.
∆Hºобр298 = ,
где εij − энергия связи; ni − число твердых атомов исходных элементов; Qi − соответствующая им теплота возгонки; νij−стехиометрические коэффициенты в уравнении реакции [3].
- метод Коновалова:
C6H10O C6H10O +8O26CO2+5H2O
ΔHсгор=-(48,8* n+10.6* m+ x)=-(48.8*16+10.6*5+12)= - 845.8ккал/моль=
= - 3535.444кДж/моль
C6H12O C6H12O+17/2O26CO2+6H2O
ΔHсгор=-(48,8*17+10,6*6+12)= - 905.2ккал/моль= - 3783.736кДж/моль
- По энергиям связи:
C6H10O 6С+1/2O2+5H2C6H10O
ΔHобр=∑(ni Ei)исх+∑(ni*Qiвозг)-∑(miEi)прод
ΔHобр(C6H10O)=6Qcвозг +1/2Eo=o+5EH-H-10EC-H-6EC-C-1EC-O =
=6*125+1/2*117.2+5*103.2-10*85.6*-6*62.8-156= - 64.2ккал/моль=
= - 268.356кДж/моль
C6H12O 6C+6H2+1/2O2 C6H12O
ΔHобр(C6H12O)= 6Qcвозг +1/2Eo=o+6EH-H-11EC-H-1EC-O-1EO-H =
=6*125+1/2*117.2+6*103.2-11*85.6*-6*62.8-75-100= - 65.6ккал/моль=
= - 274.208 кДж/моль
Dотн=(-294,97-274,21)*100%/294,97=7%
3. Метод Караша
C6H10O
ΔHсгор=-26,05*(4С+Н-Р)+а=-26,05*(4*6+10-2)-6,5= - 840,1 ккал/моль=
= - 3511,6кДж/моль
C6H12O
ΔHсгор=-26,05*(4*6+12-2)-3,5= - 889,2 ккал/моль= - 3716,9 кДж/моль
По справочнику [2]: ΔHсгор(C6H12O) = - 890,7 ккал/моль
ΔHсгор(C6H10O) = - 842,5 ккал/моль
Таблица 10.
Табл |
Караша |
Δ, % |
Коновалова |
Δ, % |
Эн. связи |
Δ, % |
|
ΔHсгор(C6H12O), ккал/моль |
- 890,7 |
- 889,2 |
0,12 |
- 905,2 |
1,6 |
- 65,6 |
92 |
ΔHсгор(C6H10O), ккал/моль |
- 842,5 |
- 840,1 |
0,3 |
- 845.8 |
0,4 |
- 64,2 |
92 |
Вывод: На основе расчётов термодинамических величин эмпирическими
методами можно сделать вывод о том, что наиболее приемлемым и
точным является расчёт методом Караша, т.к. оба вещества находятся в газообразном состоянии и данный метод предназначен для расчета ΔH газообразных веществ.
5. Кинетический расчет
Кинетические расчёты являются неотъемлемой частью проектирования любого химического процесса. Целью кинетического расчёта является нахождение кинетической модели. Кинетическая модель – это математическое выражение скорости химической реакции. Знание кинетической модели позволяет определить время проведения реакции и осуществления последующих расчётов оборудования.
В настоящее время отсутствуют надёжные кинетические уравнения, позволяющие найти кинетическую модель не прибегая к эксперименту. В связи с этим кинетическая модель химического процесса находится только после проведения эксперимента [3].
Используя данные по кинетике основной реакции определить порядок реакции интегральным и дифференциальным методами.
Произвести расчет порядка реакции методом графического дифференцирования. Определить величину энергии активации графическим методом и составить полное кинетическое уравнение.
Данные для кинетических расчетов.
Таблица 11.
Время, с |
0 |
9,16 |
20,4 |
34,5 |
52,4 |
75,6 |
106,6 |
149,1 |
209,6 |
300,1 |
Сi,0,моль/л |
0,09 |
0,084 |
0,078 |
0,072 |
0,066 |
0,061 |
0,055 |
0,049 |
0,043 |
0,037 |
5.1. Определение порядка реакции
Интегральный метод.
1) Допустим, что уравнения I порядка, тогда:
КI = 1/τ*lnC0/C
КI1 = 1/9,16*ln(0,09/0,084)=0,007532
КI2 = . . .
. . . . .
КI9 = 1/300,1*ln(0,09/0,037)=0,002962
2) Для реакции II порядка:
КII = 1/τ*(1/C-1/C0)
КII1= 1/9,16*(1/0,084 - 1/0,09)=0,086643
КII2= . . .
. . . . . .
КII9= 1/300,1*(1/0,037-1/0,09)=0,053035
3) Если реакция III порядка, то:
КIII= ½(τ)*(1/C2-1/C02)
КIII1 = ½(9,16)*(1/0,0842 - 1/0,092)=0,997083
КIII2 = . . .
. . . . . .
КIII9 = ½(300,1)*(1/0,0372-1/0,092)=1,011335
Результаты расчетов сведем в таблицу 12.
Таблица 12.
Время, с |
Сi0, моль/л |
I порядок |
II порядок |
III порядок |
0 |
0,09 |
|||
9,16 |
0,084 |
0,007532 |
0,086643 |
0,997083 |
20,4 |
0,078 |
0,007015 |
0,083794 |
1,002666 |
34,5 |
0,072 |
0,006468 |
0,080515 |
1,006441 |
52,4 |
0,066 |
0,005919 |
0,077107 |
1,012515 |
75,6 |
0,061 |
0,005145 |
0,069872 |
0,960901 |
106,6 |
0,055 |
0,00462 |
0,066329 |
0,97149 |
149,1 |
0,049 |
0,004078 |
0,062354 |
0,982684 |
209,6 |
0,043 |
0,003524 |
0,057942 |
0,995649 |
300,1 |
0,037 |
0,002962 |
0,053035 |
1,011335 |
Вывод: так как константы скоростей в расчете для реакции III порядка отличаются незначительно, то следовательно реакция получения циклогексанона - III порядка. Для подтверждения данного порядка рассмотрим дифференциальный метод определения порядка реакции.
Дифференциальный метод.
Построим графики зависимостей:
lnC0/C=f(τ); 1/С= f(τ); 1/С2= f(τ) для нахождения порядка реакции.
Данные для построения графиков.
Таблица 13.
Время, с |
Сi0, моль/л |
lnC0/C |
1/С |
1/С2 |
0 |
0,09 |
0 |
11,11111 |
123,4568 |
9,16 |
0,084 |
0,068993 |
11,90476 |
141,7234 |
20,4 |
0,078 |
0,143101 |
12,82051 |
164,3655 |
34,5 |
0,072 |
0,223144 |
13,88889 |
192,9012 |
52,4 |
0,066 |
0,310155 |
15,15152 |
229,5684 |
75,6 |
0,061 |
0,388936 |
16,39344 |
268,745 |
106,6 |
0,055 |
0,492476 |
18,18182 |
330,5785 |
149,1 |
0,049 |
0,607989 |
20,40816 |
416,4931 |
209,6 |
0,043 |
0,73861 |
23,25581 |
540,8329 |
300,1 |
0,037 |
0,888892 |
27,02703 |
730,4602 |
Рис. 6. Зависимость ln(С0/С)=f()
Рис. 7. Зависимость 1/С= f()
Рис. 8. Зависимость 1/С2= f()
Вывод: на графике зависимости 1/С2=f() прямая линия, то есть по результатам интегрального метода определения порядка реакции эта реакция - III порядка.
Метод графического дифференцирования.
Данные для построения графика.
Таблица 14.
Время, с |
0 |
9,16 |
20,4 |
34,5 |
52,4 |
75,6 |
106,6 |
149,1 |
209,6 |
300,1 |
Сi,0,моль/л |
0,09 |
0,084 |
0,078 |
0,072 |
0,066 |
0,061 |
0,055 |
0,049 |
0,043 |
0,037 |
Для этого необходимо построить график зависимости С=f(τ), построить касательные и для них определить тангенсы углов наклона, а следовательно и скорости реакции.
Рис. 9. Зависимость С=f(τ)
tgα=ΔC/Δτ=vр
tgα1=(0,085-0)/270=0,000315 моль/л*с
tgα2=(0,082-0)/325=0,000252 моль/л*с
tgα3=(0,068-0,02)/330=0,000145 моль/л*с
tgα4=(0,051-0,03)/390=0,000054 моль/л*с
Прологарифмируем значения vр и Сi, полученные данные занесём в таблицу:
Данные для построения графика.
Таблица 15.
lnС |
- 2,52573 |
- 2,76462 |
- 3,03655 |
- 3,27017 |
lnυ |
- 7,94621 |
- 8,28608 |
- 8,83878 |
- 9,82653 |
Построим график зависимости lnС=f (ln υ) для определения тангенса угла наклона прямой, а затем порядка реакции.
Рис. 10. График зависимости lnС=f (ln υ)
tgφ=ΔLnC/ΔLn(Vp)=n
tgφ=n=(10-2)/(3,4-0,2)=2,5
Вывод: на основе результатов расчётов порядка реакции графическим и аналитическим методами можно сказать, что реакция III порядка.
5.2. Расчет активационных параметров и установление
кинетической модели.
Данные для расчета величины энергии активации.
Таблица 16.
Температура, К |
793 |
813 |
833 |
853 |
Константа, с-1 |
5,05*10 -2 |
7,28*10 -2 |
0,03 |
0,143 |
1/Т*10-3 |
1,261 |
1,23 |
1,2005 |
1,1723 |
lnК |
-2,9858 |
-2,62004 |
-3,5066 |
-1,9449 |
Графический метод
Для этого метода необходимо построить график зависимости lnK=f(1/T).
Рис.11. График зависимости lnK=f(1/T).
lnK=lnA0 – Eакт./(R*T);
tgα=ΔlnK/(Δ1/T)=-Eакт./R;
tgα= (-3,26-(-2,28))/(0,00128 - 0,00116)= - 8167,7
Eакт.гр. = - R*tgα
Eакт.гр.= - 8,314*(-8167,7) = 67899,7 (Дж/моль)
Аналитический метод:
Eакт.ан. =(R*T1*T2*ln(K2/K1))/(T2 – T1);
Т1Т2 |
98021,04 |
Т1Т3 |
-71502,16 |
Т1Т4 |
97561,40 |
Т2Т3 |
-249576,34 |
Т2Т4 |
97314,19 |
Т3Т4 |
461271,90 |
Среднее |
72181,67 |
Eакт. ср= 72181,67 Дж/моль
G%= ((Eакт.гр - Eакт. ан)/ Eакт. ан)*100%
G%=((67899,7 - 72181,67) / 72181,67)*100% = - 5,8 %.
Запишем общее кинетическое уравнение.
υр = к•е• или υр = 2,825*103 •e•
Вывод: Данная реакция относится к реакциям третьего порядка, что подтверждается аналитическим и графическим методом. Также определена и энергия активации (72181,67 Дж/моль), причем графический метод дает небольшую ошибку.
На скорость реакции влияет температура, причем с ростом температуры уменьшается скорость реакции, следовательно: реакционную смесь нужно не нагревать, а охлаждать. При этом нужно учитывать концентрацию реагирующих веществ, с уменьшением концентрации происходит увеличение скорости реакции. Расчеты показывают, что равновесие реакции сдвинуто в сторону циклогексанона. Кинетическая модель реакции имеет следующий вид:
υр = 2,825*103 •e•
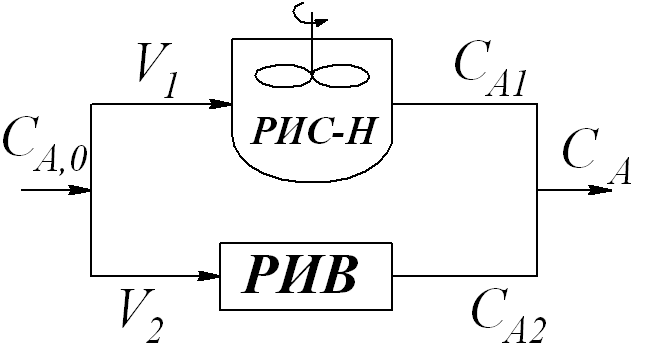
6. Сравнительный расчет изотермических реакторов идеального смешения.
По гидродинамическому режиму реакторы делятся на реакторы смешения и вытеснения. В реакторах идеального смешения непрерывного действия происходит мгновенное изменение параметров в объёме системы, которые соответствуют также выходным параметрам реактора. Такой реактор относят к реакторам дифференциального типа.
В реакторах идеального вытеснения все частицы движутся в одном направлении с одинаковыми скоростями, без продольного и поперечного перемешивания. Такой режим иногда достигается в реакторах цилиндрической формы при отношении длины к диаметру больше 20, определенных значениях критерия Рейнольдса и в маловязких средах.
Применение РИС-Н и РИВ для определенных процессов зависит от объемного расхода, размеров и интенсивности, о чем можно судить из расчетов реакторов [3].
Используя проектные уравнения рассчитать и сравнить объёмы РИС – Н и РИВ. Определить интенсивность реакторов.
Данные для расчета реакторов.
Таблица 17.
Объемный расход реагента А, Gv,А0, м3/час. |
5,0 |
Объемный расход реагента В, Gv,,В0, м3/час. |
3,4 |
Степень превращения ХА |
0,75 |
Молярное соотношение реагентов А ׃В |
1׃2,2 |
Начальная конц-ция реагента А в исходном потоке СА,0, моль/л |
3,5 |
Константа скорости, К л/моль*мин |
2,3 |
Число реакторов в каскаде, m |
4 |
Уравнение скорости |
v=к*СА*СВ |
Из мольного соотношения реагентов А и В, и начальной концентрации реагента А выразим начальную концентрацию реагента В.
=> СВ=СА*2,2 => v=К*СA*СВ=К*СА2*2,2;
Gv,0=Gv,А0 + Gv,B0=5,0+3,4=8,4 (м3/час)
Согласно проектному уравнению реактор идеального смешения непрерывного действия.
м3
CA = CA,0(1-ХА);
Согласно проектному уравнению РИВ:
Вывод: Сравнивая объёмы, можно сделать вывод, что использование реакторов идеального вытеснения более целесообразно, т.к. при том же объёмном расходе его объём меньше, он занимает меньше места, прост в обслуживании, требуется меньше энергетических затрат, отвечает технологии процесса, таким образом, его использование более целесообразно в данном процессе.
Сравнительный расчет РИС-Н-К
При заданном числе реакторов одинакового объёма, используя графический метод, рассчитать объём реактора РИС–Н при последовательном соединении (каскад реакторов РИС–Н–К), а также их общий объём. Сравнить объёмы РИС – Н, РИВ и РИС–Н–К и сделать вывод об их интенсивности.
Данные возьмем из сравнительного расчета РИС – Н и РИВ.
XA,0=0, до ХА,8=0,75 с шагом 0,1
CA,1= CA,0(1-ХА)=3,5*(1-0,05)= 3,325 моль/л;
CA,2= CA,0(1-ХА)=3,5*(1-0,15)= 2,975 моль/л;
CA,3= CA,0(1-ХА)=3,5*(1-0,25)= 2,625 моль/л;
CA,4= CA,0(1-ХА)=3,5*(1-0,35)= 2,275 моль/л;
CA,5= CA,0(1-ХА)=3,5*(1-0,45)= 1,925 моль/л;
CA,6= CA,0(1-ХА)=3,5*(1-0,55)= 1,575 моль/л;
CA,7= CA,0(1-ХА)=3,5*(1-0,65)= 1,225 моль/л;
CA,8= CA,0(1-ХА)=3,5*(1-0,75)= 0,875 моль/л;
vр=К* CA* CВ=2,2*К* CA2
vр=2,2*2,3*0,8752=3,874 моль/л*мин;
vр=2,2*2,3*1,2252=4,329 моль/л*мин;
vр=2,2*2,3*0,6752=4,810 моль/л*мин;
vр=2,2*2,3*0,5752=5,316 моль/л*мин;
vр=2,2*2,3*0,4752=5,847 моль/л*мин;
vр=2,2*2,3*0,3752=6,404 моль/л*мин;
vр=2,2*2,3*0,2752=6,986 моль/л*мин;
vр=2,2*2,3*0,1752=6,986 моль/л*мин;
vр=2,2*2,3*0,0752=6,986 моль/л*мин;
Таблица 18.
ХА |
0,75 |
0,65 |
0,55 |
0,45 |
0,35 |
0,25 |
0,15 |
0,875 |
1,225 |
1,575 |
1,925 |
2,275 |
2,625 |
2,975 |
|
Vр,моль/л*мин |
3,874 |
7,593 |
12,55 |
18,75 |
26,19 |
34,87 |
44,78 |
Построим график зависимости CA=f(vр) и найдем тангенс угла наклона.
Рис. 12. Зависимость VP=f(CA)
tgα=Δvp/ΔCA;
tgα=(27 - 1) / (3,5 - 2,3) = 21,67;
τ=1/ tgα=1/21,67 = 0,026 мин.
V= τ* Gv,0/60=0,026*8,4/60=0,004 м3
Vрис-нк=V*m=0,004*4=0,016 м3
Вывод: сравнивая объёмы и интенсивности реакторов РИС–Н и РИС-Н-К, можно заключить, что использование реакторов РИС-Н-К (при заданном количестве реакторов) более целесообразно, т.к. при том же объёмном расходе их общий объем меньше, чем у одного реактора идеального смешения непрерывного действия, но т.к. реакция гетерофазная, то её целесообразнее проводить в РИВ к тому же в ходе расчета установили, что минимальный объем реактора получается для реактора идеального вытеснения, а значит и большая производительность.
7. Расчёт реальных реакторов с учетом функции распределения.
Для реального технологического процесса необходимо посчитать среднюю концентрацию и среднее значение степени превращения, так как на практике значения концентраций и степени превращения не одинаковы и имеют определенный интервал.
С учётом функции распределения частиц рассчитаем среднюю конечную концентрацию СА и среднюю степень превращения ХА, если действительное время пребывания в реакторе совпадает с действительным временем в опытах с трассером.
Данные для определения средней конечной концентрации и средней степени превращения
Таблица 19.
τ,с |
6 |
12 |
18 |
24 |
30 |
36 |
42 |
48 |
54 |
60 |
66 |
72 |
78 |
84 |
90 |
С |
4 |
8 |
18 |
30 |
38 |
49 |
60 |
72 |
84 |
74 |
60 |
50 |
41 |
30 |
18 |
К=0,072 л/моль*с; n=1; ε = - 0,1362.
Рис. 13. Зависимость Си=f()
Для реакции I порядка характеристическое уравнение, определяющее концентрацию реагента в элементарном объёме, имеет вид:
СА=СА,0(1-); 1-=
Е()=- функция распределения для реактора идеального смешения.
=720/15=48; СА,0=0,084 моль/м3
ХА=1 -
Х1=1 - е-0,072*6/(1+(-0,1362)(1-е-0,072*6))=0,318
Х2=1-е-0,072*12/(1+(-0,1362)(1-е-0,072*12))=0,542
Х3=1-е-0,072*18/(1+(-0,1362)(1-е-0,072*18))=0,696
Х4=1-е-0,072*24/(1+(-0,1362)(1-е-0,072*24))=0,800
Х5=1-е-0,072*30/(1+(-0,1362)(1-е-0,072*30))=0,869
Х6=1-е-0,072*36/(1+(-0,1362)(1-е-0,072*36))=0,914
Х7=1-е-0,072*42/(1+(-0,1362)(1-е-0,072*42))=0,944
Х8=1-е-0,072*48/(1+(-0,1362)(1-е-0,072*48))=0,963
Х9=1-е-0,072*54/(1+(-0,1362)(1-е-0,072*54))=0,976
Х10=1-е-0,072*60/(1+(-0,1362)(1-е-0,072*60))=0,985
Х11=1-е-0,072*66/(1+(0,1362)(1-е-0,072*66))=0,990
Х12=1-е-0,072*72/(1+(-0,1362)(1-е-0,072*72))=0,993
Х13=1-е-0,072*78/(1+(-0,1362)(1-е-0,072*78))=0,996
Х14=1-е-0,072*84/(1+(-0,1362)(1-е-0,072*84))=0,997
Х15=1-е-0,072*90/(1+(-0,1362)(1-е-0,072*90))=0,998
=1-=0,818
=СА,0(1-)=0,084*(1-0,818)=0,0153
Вывод: средняя степень превращения и средняя конечная концентрация отличаются от мгновенных значений этих величин в приведенный момент времени , что указывает на отклонение режима работы от идеального. Дифференциальная функция распределения частиц по времени пребывания не отличается особой точностью в реальных процессах.
8. Расчет произвольной системы соединенных идеальных реакторов.
Определить производительность по продукту реакции при заданной схеме соединения реакторов РИС–Н и РИВ (параллельное и последовательное соединения) и установить какая из схем соединения является более эффективной.
Данные для определения производительности.
Таблица 20.
GА,0,кмоль/с |
0,0022 |
Константа скорости К, л2/моль2*мин |
0,0058 |
СА,0,кмоль/м3 |
3,0 |
СВ,0,кмоль/м3 |
2,1 |
V2 рив, м3 |
4,5 |
V1 рис–н, м3 |
2,8 |
Уравнение реакции: А +2В → С
Общие задачи систем, состоящих из последовательно или параллельно соединенных реакторов различного типа с разными объёмами можно решить путем совместного анализа соответствующих проектных уравнений.
Рассмотрим схему параллельного соединения реакторов.
При использовании параллельной схемы рекомендуется в каждой линии поддерживать такую скорость, чтобы концентрация вещества была одинаковой во всех линиях.
СА,1=СА,2=СА
СB=СB,0 – 2(СА,0 –СA,1)
Запишем уравнение материального баланса для РИС – Н
Gвх=Gвых+υp*V →
G01CA0=G01 CA1 + k CA CB V1 =G01 CA + k CA [СB,0 – 2(СА,0 –СA)] V1→
;
Время пребывания для РИВ:
CA
τ =V/G0,2= -∫dCA/(K*CA*(CB,0 – 2*(CA,0 – CA)))
CA,0
=>
;
GV,0= GА,0/ СА,0 =0,0022/3,0=0,00073 м3/с;]
Корень этого уравнения при исходных данных рассчитан в MatCad:
СА=2,392 кмоль/м3
Производительность по продукту С:
Gc=Cc*GV,0=(СА,0 -СА)* GV,0=(3 – 2,392)* 0,00073 = 0.00044384 кмоль/с.
Рассмотрим схему последовательного соединения реакторов.
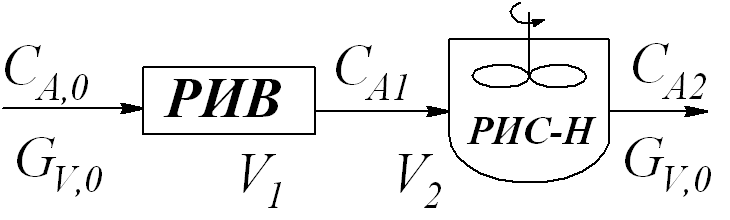
Для РИВ:
; =>
=>
СА,1=1,95 кмоль/м3
СВ,1 = CB,0 - 2*( СА,0 - СА,1)=2,1 - 2*(3.0 – 1,95)=0 кмоль/м3
Для РИС – Н:
GV,0=(Vрис - н*К* СА,2 *( CB,1- 2* ( СВ,1 - СА,1))/( СА,1 - СА,2);
0,00073=
СА,2=0,198 кмоль/м3
Gc=( СА,0 - СА,2)* GV,0=(3,0 - 0,198)* 0,00073 = 0,00205 кмоль/с
Вывод: рассмотрев различные способы соединения между собой реакторов, нашли, что максимальная производительность при заданных условиях
(GC=0,00205 кмоль/с) будет при использовании последовательного
соединения РИС-Н и РИВ.
9. Схема основного аппарата и его описание.
Каталитическое окисление циклогексана проводится в жидкой фазе воздухом или техническим кислородом при повышенном давлении и температуре: давление колеблется от 20 до 50 атм, температура от 130 до 180° С. Катализатор (который засыпается в колонну через люки Ж) дает возможность проводить реакцию окисления при более низкой температуре, чем при некаталитическом процессе, тем самым уменьшается развитие процессов более глубокого окисления. Наряду с циклогексанолом и циклогексаноном, при окислении циклогексана образуются продукты более глубокого окисления, главным образом дикарбоновые кислоты. В продуктах окисления обнаружены адипиновая, глутаровая и янтарная кислоты.
Реакциям глубокого окисления способствует увеличение степени конверсии Циклогексана и повышение температуры. Поэтому для предотвращения образования продуктов глубокого окисления циклогексана степень конверсии последнего обычно поддерживают не выше 10%. Путем интенсивного отвода тепла реакции удается поддерживать изотерический режим во всем реакционном объеме и избегать повышения температуры сверх необходимой.
Реакционный аппарат (окислительную колонну) изготавливают из высоколегированной хромоникелевой стали. В реакторе установлены змеевики; отвод тепла осуществляется за счет испарения в этих змеевиках воды. Циклогексан подается через штуцер Б, распределяясь по поверхности катализатора контактирует с воздухом подаваемым через штуцер Д, расположенным в днище аппарата. Кроме воздуха, в реактор подают воду (штуцер В) в количестве 5% от расходуемого циклогексана; вода растворяет продукты окисления кислотного характера.
Отходящий газ (через штуцер Г) состоит в основном из азота; в нем имеется около 2% СО2, 1—2% СО, следы циклогексана и других углеводородов. Кислород воздуха практически весь связывается. Время пребывания смеси в реакционном аппарате составляет 10 мин [4].
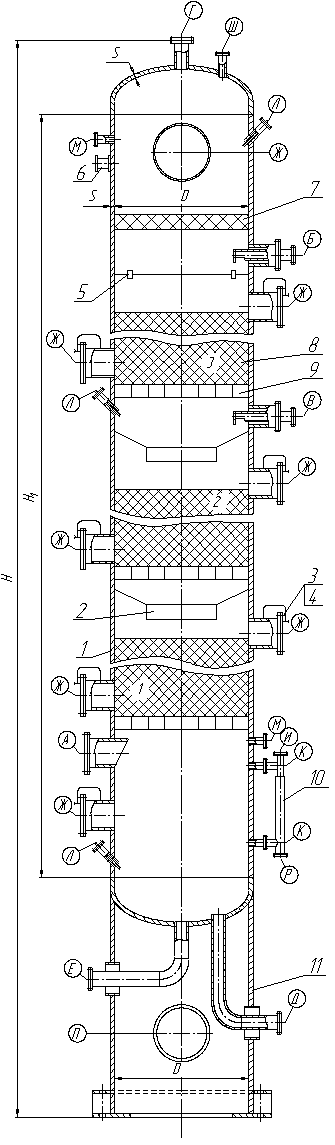
Рис.14. Контактный аппарат окисления циклогексана.
10. Технологическая и структурная схема и их описание.
Каталитическое окисление дает лучшие результаты при окислении нафтенов С5-С6 и этим способом из циклогексана получают циклогексанол и циклогексанон. В качестве катализатора наиболее эффективны соли кобальта при температуре 120-1600С и давлении 1-2 МПа. Для получения выхода циклогексанола и циклогексанона порядка 80% окисление ведут в каскаде из 3-4 барботажных колонн.
Окисление ведут в каскаде барботажных колонн 1 с последовательным перетоком жидкости и подачей воздуха в каждую колонну. Тепло реакции снимается за счёт испарения избыточного циклогексана, который конденсируется в общем для всех колонн холодильнике 2, отделяется от газа в сепараторе 3 и возвращается обратно в линию циклогексана. Оксидат из последней колонны проомывают водой для выделения низших кислот в смесителе 4 и отделяют от водного слоя 5. Затем из оксидата в колонне 6 отгоняют осевшую массу циклогексана, оставляя в кубе такое его количество, чтобы концентрация гидроксида не превышала безопасного уровня (34%). Кубовую жидкость обрабатывают при нагревании в каскаде аппаратов 7 с мешалками водной щелочью. При этом происходит окисление сложных эфиров и кетонов, а также разложение гидропероксида. Органический слой, отделяют от водного слоя в сепараторе 8 и отгоняют от него циклогексан в колонне 9. Циклогексан из колонн 8 и 9 и из сепаратора 3 возвращают на окисление. Кубовая жидкость колонны 9 содержит циклогексанол, циклогексанон и нейтральные побочные продукты. Из них в колонне 10 отгоняют циклогексанон, а в колонне 11 – циклогексанол, который дегидрируется (окислением кислородом) в аппарате 12 в циклогексанон [5].
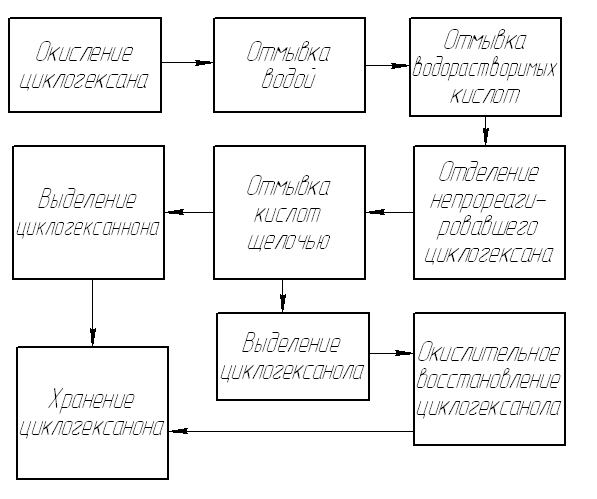
Рис.16. Структурная схема процесса окисления циклогексана в циклогексанон
Выводы.
В данной курсовой работе мы определили графическим и аналитическим методами, что реакция третьего порядка, что не соответствует её молекулярности, т.к. кислород находится в избытке, а циклогексан – в недостатке, энергия активации процесса окисления циклогексана составляет 72,1817 кДж/моль. Кинетическое уравнение имеет вид:
υр = 2,825*103 •e•
Сравнивая объёмы и интенсивности реакторов РИС – Н и РИВ, мы установили, что использование реакторов идеального вытеснения более целесообразно, т.к. при том же объёмном расходе объём его меньше, он занимает меньше места, прост в обслуживании, требуется меньше энергетических затрат, отвечает технологии процесса.
Рассмотрев различные способы соединения между собой реакторов, нашли, что максимальная производительность при заданных условиях (GC=0.0013346 кмоль/с) будет при использовании последовательного соединения РИС-Н и РИВ.
Список литературы
- Производство капролактама / В.И. Овчинников, В.Р. Ручинский, М.: Химия, 1977. 246 с.
- Краткий справочник физико-химических величин / К.П.Мищенко, А.А.Равдель, Л.: Химия, 1974. 200 с.
- Инженерная химия. Руководство к практическим занятиям: учеб. пособие/ Ю.В.Попов, К.Ф.Красильникова, Т.К.Корчагина, Г.М.Бутов/ ВолгГТУ.- Волгоград, 2005. 184с.
- Основные процессы и аппараты химической технологии: Пособие по проектированию / под ред. Дытнерского Ю.И. М.: Химия, 1991. 496 с.
- Лебедев Н.Н. Химия и технология основного органического и нефтехимического синтеза. М.: Химия, 1981. 605с.